|
Concentración de sal en el mar:
La concentración de sal en los océanos no es constante sino que varía mucho de unos mares a otros. Por término medio, un litro de agua marina contiene entre 33 y 39 gramos de sal. El agua dulce procedente de los ríos, glaciares y precipitaciones disminuye la salinidad oceánica.
La evaporación la hace aumentar. La concentración de sal tiende a homogeneizarse porque los océanos están conectados entre sí. La concentración puede mostrar diferencias verticales y regionales. Las primeras se producen por el encuentro de masas acuosas, como sucede en el Atlántico norte: las corrientes saladas del Golfo confluyen con las del mar del Labrador.
Un ejemplo de una variación regional la encontramos en la zona oriental del Mediterráneo. Debido a que llueve poco y se produce una gran evaporación, el agua es ligeramente más salada. Mayor salinidad presenta el mar Rojo, entre tierras desérticas, donde desde el estrecho de Bab-el-Mandeb, la sal aumenta hasta llegar al máximo en el fondo del golfo de Suez.
Entre los océanos, el Atlántico presenta el grado más intenso de salinidad. Llega a 37 gramos por litro en las zonas topicales. El Pacífico es el que más se aproxima a la salinidad media.
Las costas con baja salinidad debido al aporte de grandes ríos son el golfo de Guinea, donde desembocan el Zaire y el Níger, El Amazonas y el Plata en América del sur; y el Ganges y el Brahmaputra en el golfo de Bengala.
El estrecho de Gibraltar, de 65 km de largo y con una anchura entre 14 y 39 km, posee un canal de 8 km de ancho que atraviesa el centro del estrecho, con una profundidad de 300 m. Desde el Atlántico penetra una corriente continua, y hay corrientes de marea que corren a lo largo de las costas europea y africana. Una corriente submarina que fluye hacia el oeste arrastra el exceso de agua salada del Mediterráneo.


Origen de los océanos:
Una vez que la atmósfera terrestre se saturó de vapor de agua, éste comenzó a condensarse, cayendo sobre la superficie cálida y creando las primeras charcas y lagos. Estas primeras masas de agua no eran estables. Al menos durante los primeros 600 ó 700 millones de años, el calor desprendido por el impacto de los cometas y asteroides habría vaporizado parte del agua. Los océanos se originaron probablemente pocos millones de años después del nacimiento del planeta. Hace 4.000 millones de años la superficie oceánica soportaba una presión atmosférica equivalente a la que se alcanza hoy a 400 metros bajo el nivel del mar.
A principios del siglo XX los cálculos que se barajaban sobre la edad de la Tierra eran muy variados y desacertados por muchos millones de años.
Edmond Halley especuló con la posibilidad de realizar el cálculo basándose en la sal disuelta en los mares.
Partió de la hipótesis de que originalmente el agua del mar no era salada. La pequeña cantidad de sal que aportan los ríos se acumularía en el mar al evaporarse el agua. La idea fue retomada por John Holy (1899), del Trinity College de Dublín, destacado en el desarrollo de técnicas para medir la edad geológica según la radioactividad de los minerales. Pensó que si se conocía la cantidad de sal que los ríos llevan al mar en un año, podría determinarse el tiempo necesario para que los océanos alcanzasen la salinidad actual.
Su intento incurrió en varios supuestos erróneos y fue totalemente incorrecto. Calculó un valor comprendido entre 90 y 99 millones de años.
Talasoterapia:
Aprovecha los beneficios para el organismo del agua del mar, el plancton y las algas, por los oligoelementos y las sales minerales que aportan. Especialmente cultivada en Francia. Hay termas troglodíticas y templos construidos hace 3000 años para aliviar dolencias. El termalismo está viviendo un nuevo auge. Los viejos balnearios han sido remozados o convertidos en instalaciones modernas donde vuelven a tomar las aguas reumáticos, ejecutivos estresados, o personas con traumatismos o problemas respiratorios. A la bonanza del clima, el ambiente relajado y la alimentación adecuada, se suman los específicos tratamientos de la talasoterapia que en España también han hecho su aparición, y que van desde las duchas enérgicas con agua de mar, de efecto drenante, hasta los distintos masajes con productos marinos -cataplasmas de algas, cremas, jabones...- para activar la circulación sanguínea y hacer que los principios activos penetren a través de la piel.
Durante muchos siglos no se logró convencer a la gente de las bondades de los baños en el mar.
El veneciano Niccolo Massa, médico especialista en el mal francés, autor del tratado, De morbo gallico, afirmaba que los que se bañan en la salada agua marina ensordecían, aparte de tener hijos tontos, calvos, prematuros y con la piel muy alterada. Entre los habitantes de Bretaña en Francia se creía que los baños de mar producían la calvicie.
Richard Russell, pionero de las curas de aguas escribió (1750) en latín un libro sobre las propiedades curativas del agua de mar, traducido al inglés cuatro años más tarde como A Dissertation Concerning the Use of Sea-Water in Diseases of the Glands. Recomendaba el agua de mar como tratamiento de trastornos como la gota, el reuma y hasta la congestión cerebral. Los enfermos no sólo tenían que sumergirse en agua de mar, sino además beberla en grandes cantidades. Abrió consulta en el pueblo pesquero de Brighthelmstone, en la costa de Sussex, que más tarde se convertiría en Brighton, el centro turístico costero más en boga del mundo en su época.
Al principio muchos se bañaban desnudos causando gran indignación. Los más recatados se envolvían en ropas que resultaban incluso peligrosas. Las clases bajas imitaron este nuevo comportamiento desnudándose en la playa «en cantidades promiscuas». Se impuso la solución pudorosa de carromatos que eran arrastrados hasta el agua, con puertas y peldaños que permitían al cliente entrar en el agua con seguridad y discreción. Cuando se iba imponiendo la moda Scarborough, en la costa de Yorkshire, garantizaba que sus aguas eran un bálsamo contra la «Apoplejía, Epilepsia, Catalepsia, Vértigo, Ictericia, Melancolía Hipocondriaca y Flatulencia».
Uno de los centros turísticos más reputados de la costa francesa es el puerto pesquero de Granville, en la Baja Normandía. En el siglo XIX, después de haber sido refugio de corsarios, se convirtió en un elegante balneario al que acudían los parisinos y personajes tan relevantes como Stendhal o Victor Hugo.

Conservación de alimentos:
Junto con el secado al sol, la sal constituye uno de los métodos más antiguos de conservación de alimentos. El método era empleado por los antiguos egipcios y se usaba en China tres milenios a.C. Los microbios no soportan una salinidad excesiva. Retira el contenido acuoso de los alimentos: por debajo de un 0,60 de actividad de agua no crece prácticamente nada. Los microorganismos mueren deshidratados al perder por ósmosis gran cantidad de agua a través de sus membranas. Algunas bacterias como las del género Sarcina son inmunes. Proliferan en el bacalao salado tiñéndolo de rosa aunque no son patógenas.
Determinadas bacterias potencian las propiedades nutritivas y el sabor de los alimentos y resultan de gran importancia en muchas industrias. La capacidad fermentadora de ciertas especies es aprovechada en la producción de queso, yogur, adobos y salazones. También resultan importantes en el curtido de cueros, la producción de tabaco, la conservación del grano, los tejidos, los fármacos, y en la elaboración de varios tipos de enzimas, polisacáridos y detergentes.
Para salar pescados la fase de apilado consiste en colocarlos durante unos 10 días separados por una capa de un centímetro de sal.
Para conservar en salazón es habitual añadir nitrato sódico, nitrito, pimentón, semillas de eneldo o mostaza.
Con la generalización y mejora de los procesos de refrigeración, congelación y envasado decayó el uso del laborioso proceso de salazón de carnes y pescados.
Cencinas y jamón serrano siguen aportando una calidad que mantiene una demanda estable.
|
Comercio de la sal:
Su obtención por evaporación solar o por extracción, es fácil. En consecuencia, los intercambios internacionales afectan sólo al 20% de la producción mundial, que alcanza los 200 millones de toneladas. Los Estados Unidos proporcionan el 20% de este tonelaje, y la China, el 15%. México, el séptimo productor mundial, produce 8 millones de toneladas de sal al año, que exporta al Japón y a América del Norte... La química acapara el 60% de la sal consumida cada año en el mundo, mientras que el 10% sirve para la protección de las carreteras contra las heladas. El resto aprovisiona a las industrias pesqueras (conservación) y de alimentación y llena los saleros de mesa. Un individuo ingiere de 7 a 8 g de sal por día. Consumida en exceso, la sal es nefasta para la salud y favorece la hipertensión arterial. Sin embargo, los alimentos industriales la contienen en mucha cantidad. Así, el 20% de la población francesa absorbe sal en exceso: más de 12 g al día. (Yann Arthus-Bertrand)
|
Los vagones con sal para Kolberg (1944):
En el verano de 1944 un cargamento de miles de toneladas de sal disfrutó de la más alta prioridad para ser transportado en vagones de tren.
Los jerarcas del III Reich, encabezados por el ministro de Propaganda, decidieron en 1943 poner en marcha una gran producción cinematográfica que supusiera un canto a la resistencia ciudadana. Recurrieron a un pasaje de la Historia que requería trabajos preliminares como estudios históricos sobre los escenarios reales.
La idea inicial se convirtió en encargo oficial en junio, se hizo acopio de uniformes, caballos y armamento de época, y el rodaje empezó en noviembre.
Los exteriores nevados se filmaron en el verano de 1944 con extensas capas de sal simulando la nieve.
El año anterior se había pasado por la derrota en Stalingrado y las fuerzas de Rommel habían sido evacuadas de África del Norte.
La ambiciosa producción patriótica titulada Kolberg empleó a 187.000 hombres que fueron retirados del frente para participar como figurantes.
|
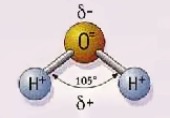
Propiedades de la molécula de agua:
Otra extraordinaria característica del agua es su enorme capacidad de disolución. Esto también se debe a la peculiar disposición de las cargas eléctricas y los átomos en la molécula de agua. Muchos compuestos están formados por iones, o átomos con carga eléctrica. Por ejemplo, la sal común (cloruro de sodio) se compone de iones de sodio con carga positiva y átomos de cloro con carga negativa (iones cloruro). En el sólido, cada ion positivo está rodeado de iones negativos, y cada ion negativo está rodeado de iones positivos. Sin embargo, el agua, con su sistema de cargas positivas y negativas, puede emular a ambos tipos de iones. Así, cuando se exponen a la acción del agua, los iones de sodio de un cristal pueden quedar rodeados por moléculas de agua que orientan hacia ellos sus átomos de oxígeno con carga negativa, emulando de este modo a los iones cloruro. De manera similar, los iones cloruro pueden quedar rodeados por los átomos de hidrógeno de la molécula de agua, que, con su carga positiva, emulan el efecto de los iones de sodio del cristal original. Ambos tipos de iones quedan cautivados: los iones de sodio flotan rodeados de moléculas de agua que emulan a los iones de cloro, y los iones cloruro flotan rodeados por moléculas de agua que utilizan sus átomos de hidrógeno para emular a los iones de sodio. El agua tiene una capacidad especial para actuar de este modo, y por eso es tan buen disolvente (y también, en determinadas circunstancias, puede resultar corrosiva y sumamente peligrosa). Esta capacidad del agua es la que le permite moldear la piedra y crear paisajes, y también transportar nutrientes a través de la tierra, haciéndolos llegar a las plantas. El agua forma una parte considerable de nuestros cuerpos, y su capacidad de asumir el libre movimiento de los iones y otras moléculas que disuelve la convierten en un ambiente adecuado para la vida. (Peter W.Atkins)
|
|